Potenciometrie
Princip metody
Poločlánek
Ponoříme-li kovovou elektrodu (např. plíšek) do roztoku, získáme Poločlánek . Na rozhraní kov/roztok se začne vytvářet elektrochemický potenciál ρ. Ke vzniku potenciálu vedou procesy:
• Rozpouštění kationů kovu v roztoku a hromadění elektronů v elektrodě, zatímco roztok se nabíjí kladně.
• Přijímání kationtů z roztoku , v elektrodě se hromadí kladný náboj a roztok se nabíjí záporně.
Oba procesy se ustaví do rovnováhy a na elektrodě se nahromadí buď kladný náboj (Cu v CuSO4) nebo záporný náboj (Zn v ZnSO4). Velikost potenciálu nelze přímo změřit ani vypočítat.
Galvanický článek
Galvanický článek je soustava vzniklá spojením dvou vhodných poločlánků. Tato soustava je schopná produkovat elektrickou práci. Voltmetrem s vysokým vnitřním odporem můžeme změřit napětí Ur. Zapojení takového voltmetru neodebírá z článku téměř žádný proud. Změřené napětí odpovídá rozdílu potenciálů zapojených elektrod.
Vzniklý potenciál je funkcí molární koncentrace studované látky a teploty. Velikost potenciálu odpovídá Nernst-Petersově rovnici .
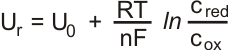
• Ur – rovnovážný potenciál elektrody
• U0r - konstanta
• R - molární plynová konstanta (8,314 J/K.mol)
• T - teplota v kelvinech (teplota ve °C + 273,15)
• n - počet vyměněných elektronů
• F - Faradayova konstanta (96485 C/mol)
• c - koncentrace oxidované nebo redukované formy
Standardní potenciál
Vlastní potenciál elektrody nelze měřit, ani počítat. Lze však potenciál porovnávat zapojením do článku. Pro určení standardních elektrodových potenciálů byla jako srovnávací elektroda zvolena elektroda vodíková. Standardní elektrodový potenciál je rovnovážné napětí článku vzniklého připojením zkoumané elektrody k vodíkové elektrodě. Zapojením zkoumané elektrody a vodíkové elektrody vznikne #SAL131#
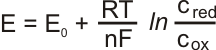
• E - elektrický potenciál elektrody
• E0 - standardní elektrodový potenciál - formální potenciál měřený při jednotkovém poměru molárních koncentrací c(ox)/c(red) = 1
• R - molární plynová konstanta (8,314 J/K.mol)
• T - teplota v kelvinech (teplota ve °C + 273,15)
• n - počet vyměněných elektronů
• F - Faradayova konstanta (96485 C/mol)
• c - koncentrace oxidované nebo redukované formy
Tabulka standardních elektrodových potenciálů vybraných kovů při 25°C
| elektroda |
E0 / V |
elektroda |
E0 / V |
| Li/Li+ |
-3,01 |
Co/Co3+ |
-0,27 |
| K/K+ |
-2,92 |
Ni/Ni2+ |
-0,23 |
| Ba/Ba2+ |
-2,92 |
Sn/Sn2+ |
-0,14 |
| Sr/Sr2+ |
-2,89 |
Pb/Pb2+ |
-0,12 |
| CaCa2+ |
-2,84 |
Fe/Fe3+ |
-0,04 |
| Na/Na+ |
-2,71 |
H2/H+ |
0 |
| Mg/Mg2+ |
-2,38 |
Cu/Cu2+ |
+0,34 |
| Al/Al3+ |
-1,66 |
Cu/Cu+ |
+0,52 |
| Zn/Zn2+ |
-0,76 |
Hg/Hg2+ |
+0,798 |
| Fe/Fe2+ |
-0,44 |
Ag/Ag+ |
+0,799 |
| Cd/Cd2+ |
-0,40 |
Au/Au3+ |
+1,36 |
V tabulce jsou uvedeny standardní elektrodové potenciály některých elektrod. Nejnižší potenciál vykazuje lithium, nejvyšší zlato. Zapojením vodíkové elektrody k vodíkové elektrodě je rozdíl potenciálů nulový.
Kovy s kladným standardním potenciálem nevytěsňují z kyselin vodík, nazýváme je ušlechtilé kovy. Kovy s nižším potenciálem mohou vytěsňovat ze sloučenin kovy s vyšším potenciálem.
Typy elektrod
Podle typu konstrukce rozlišujeme několik druhů elektrod:
• Elektrody 1. druhu
• Elektrody 2. druhu
• Elektrody oxidačně redukční
• Elektrody iontově selektivní, membránové
Podle použití rozlišujeme především:
• elektrody měrné
• elektrody referentní
Elektrody I. Druhu
Elektrody I. Druhu se dále dělí na kationové, amalgamové a aniontové.
Kationtová elektroda. Je tvořena kovem, plíškem nebo drátkem ponořeným do roztoku iontů kovu z něhož je vyrobena. Příkladem je např. elektroda stříbrná. Jedná se o Ag plíšek ponořený do roztoku Ag+ iontů.
Nernstova rovnice pro tuto elektrodu:
Mezi tyto elektrody patří i vodíková elektroda . Jedná se o platinový plíšek pokrytý platinovou černí, která je sycena vodíkem a je ponořena do roztoku obsahujícího H+ ionty. Potenciál této elektrody klesá úměrně s rostoucím pH roztoku. Lze využít pro měření pH, z praktických důvodů se k tomu však příliš nepoužívá.
Amalgamové elektrody se používají pro kovy, na jejichž povrchu se tvoří vrstva oxidu. Kov se rozpustí ve rtuti a vzniklý amalgám se použije pro výrobu elektrody.
Aniontové elektrody jsou např. elektroda chlorová, fluorová apod.
Elektrody II. Druhu
Tyto elektrody jsou tvořeny kovem, pokrytým nerozpustnou solí použitého kovu a ponořeným do roztoku aniontů sraženiny.
Např. elektroda argentchloridová je plíšek stříbra potažený vrstvou AgCl, ponořený v roztoku KCl.
Další elektrodou je elektroda kalomelová. Je tvořena kovovu rtutí, jejíž povrch je pokryt chloridem rtuťným (Hg2Cl2 - kalomel) a ponořen v roztoku KCl.
Elektrody 2. druhu se díky velké stabilitě jejich potenciálu využívají jako srovnávací (referentní) elektrody při potenciometrických měření. Srovnávací elektroda se připojuje na elektrodu měrnou, dohromady tvoří galvanický článek. Potenciál těchto elektrod není závislý na měřeném roztoku. Srovnávací (referentní) elektrody
Elektrody oxidačně redukční
Jedná se o elektrody z ušlechtilého kovy (platiny, zlata), které jsou ponořeny do roztoku obsahujícího oxidované i redukované formy iontů. (např. Fe2+, Fe3+) Elektroda se reakcí účastní pouze jako prostředník pro přenos elektronů, sama se nijak nemění.
Potenciál redoxní elektody:
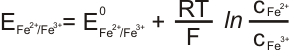
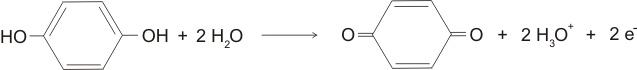
Dalším příkladem redoxní elektrody je elektroda chinhydronová. Chinhydron je směs hydrochinonu a p-benzochinonu. p-benzochinonu je oxidovaná forma hydrochinonu, podle rovnice:
Nernstova rovnice pro chinhydronovou elektrodu:
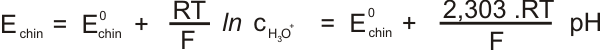
Potenciál chinhydronové elektrody je závislý na pH. V alkalickém prostředí je elektroda nestálá a pro měření pH je vhodná jen v prostředí do pH<8.
Elektrody ISE - iontově selektivní elektrody
Základní prvek ISE elektrod je selektivně propustná membrána, kterou mohou pronikat jen určité ionty (např. H3O+). Membránový potenciál vzniká při nestejné rychlosti pohybu iontů přes membránu. Ionty na obou stranách membrány mají potenciál difundovat přes membránu. Pokud difundují ionty z jedné strany rychleji, vzniká elektrochemický potenciál. Pokud by se přes membránu pohyboval jen jeden ion (ideální stav) závisel by výsledný potenciál pouze na jeho aktivitě. Jelikož je druhý ion (pronikající z druhé strany membrány) také aktivní, je třeba uvažovat o míře selektivity. Čím nižší propustnost rušícího iontu, tím je ISE elektroda selektivnější. Nejběžnější ISE elektrodou je Skleněná pH elektroda
Skleněná pH elektroda je tvořena tenkostěnnou baničkou ze speciálního skla (membrána), naplněnou roztokem HCl, do něhož zasahuje argentchloridová elektroda.
Potenciál skleněné elektrody je vyjádřen:
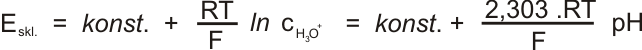
V silně zásaditém prostředí vykazuje elektroda odchylky. Elektroda také stárne a mění svůj potenciál. Proto je nutné elektrodu standardizovat změřením rovnovážného napětí při ponoření elektrod do tlumivého roztoku (pufru) o známém pH. Standardizaci je nutné pravidelně opakovat.
Potenciometrické měření
Při potenciometrickém měření vždy sestavujeme článek. Ten se skládá z elektrolytu a z měrné a referentní elektrody. Potenciál měrné elektrody závisí na koncentraci měřené látky v elektrolytu, potenciál referentní elektrody je konstantní. Měřícím zařízením je voltmetr s velkým vnitřním odporem. Nejběžnějším přímým potenciometrickým měřením je měření pH skleněnou elektrodou.
Protolýza, iontový součin vody, pH
Ve vodných roztocích dochází k protolýze vody do rovnovážného stavu. I samotná ultračistá voda obsahuje ionty oxoniové a hydroxidové, produkty autoprotolytické reakce:
Rovnovážný stav této reakce je charakterizován disociační konstantou KH2O.
Koncentrace vody je u zředěných roztoků řádově vyšší, můžeme ji považovat za konstantní. Rovnovážný stav reakce lze charakterizovat rovnovážnou konstantou KV zvanou iontový součin vody.
Hodnota iontového součinu vody má při 25°C hodnotu 10-14 mol2.l-1.
Iontový součin vody popisuje rovnováhu mezi molekulami vody, oxoniovými a hydroxidovým ionty. Rovnováha platí jak pro čistou vodu, tak i pro zředěné roztoky. Koncentrace H3O+ a OH- iontů musí být vždy takové, aby se jejich součin rovnal 10-14. V čisté vodě je koncentrace iontů H3O+ stejná jako koncentrace iontů OH-.
V r. 1909 zavedl Sörensen tzv. vodíkový exponent, pH. Důvodem bylo odstranit náročné počítání se záporným exponentem. Hodnota pH odpovídá zápornému dekadickému logaritmu koncentrace H3O+ iontů.
Pro neutrální vodu, ve které je koncentrace H3O+ iontů 10-7 je hodnota pH = 7
Podobně jako u pH, lze vyjádřit koncentraci OH- iontů pomocí pOH.
Vztah mezi koncentracemi H3O+ a OH- iontů lze vyjádřit rovnicí:
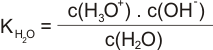
Po úpravě na pH a pOH je vztah těchto hodnot následující:

V kyselých roztocích je koncentrace H3O+ iontů vyšší než iontů OH-. U roztoků zásaditých je vyšší koncentrace iontů hydroxidových. Součin jejich koncentrací musí činit 10-14. Jestliže je c(OH-)=10-2 bude c(H3O+)=10-12 .
Silné kyseliny
U silných kyselin dochází téměř k úplné disociaci. Silné kyseliny jsou ty, u nichž disociační konstanta je vyšší než 10-2. Disociační konstanta udává míru disociace. Mezi silné kysliny patří: HI , HClO4 , H2SO4 , HNO3 , HBr , HCl , trichloroctová HIO3 , H3PO2 (jednosytná).
Pro zjednodušení se hodnota KA upravuje na pKA, podobně jako pH nebo pOH
Díky úplné disociaci odpovídá koncentrace oxoniových iontů, koncentraci silné kyseliny. Do výpočtu pH můžeme tedy dosadit na místo c(H3O+) koncentraci kyseliny c(HA).
pH silných kyselin:
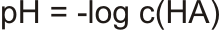
Vícesytné silné kyseliny odštěpují 2 H+ ionty. Zředěný roztok kyseliny sírové tedy obsahuje dvojnásobnou koncentraci H3O+, než je koncentrace kyseliny.
pH vícesytné kyseliny (H2SO4):

Silné zásady
Podobně jako silné kyseliny, i silné zásady plně disociují a koncentrace OH- iontů odpovídá koncentraci zásady. Silné zásady jsou: KOH, NaOH, LiOH, Ba(OH)2
pH silných zásad popisuje vztah:
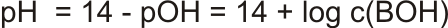
Slabé kyseliny
Slabé kyseliny ve vodných roztocích nedisociují plně. Disociace probíhá do rovnovážného stavu:

který lze vyjádřit disociační konstantou KA:
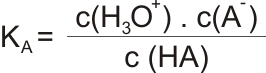
nebo pro zjednodušení hodnotou pKA:
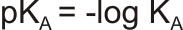
pH slabých kyselin odpovídá vztahu:
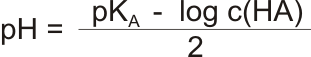
Slabé zásady
Tak jako slabé kyseliny, slabé zásady nedisociují v roztocích úplně, pouze do rovnovážného stavu:
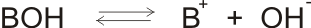
popsaného disociační konstantou zásady KB:
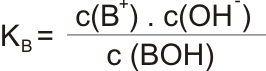
nebo pomocí pKB:

pH slabých zásad odpovídá vztahu:
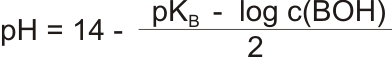
Literatura:
Jiří Gasparič: Vybrané kapitoly z fyzikální chemie pro posluchače farmacie I.díl, Karolinum, Praha 1993 BN: 382-188-92