= důkaz a stanovení funkčních skupin → reakce skupinové + selektivní
Nasycené alifatické uhlovodíky
- jsou téměř nereaktivní, pro identifikaci se využije stanovení fyzikálních konstant: teplota varu, index lomu, hustota
- ve směsi identifikace plynovou chromatografií
Nenasycené uhlovodíky
- podléhají vzhledem k reaktivitě násobné vazby neselektivním reakcím
- odbarvují roztok manganistanu draselného = redukce → stejně reagují i látky snadno se oxidující
- odbarvují roztok bromu v chloridu uhličitém = adice halogenu na nenasycenou vazbu
Aromatické uhlovodíky
- neodbarvují roztok jodu ani manganistanu
- rozlišení aromatických a alifatických uhlovodíků se provede kondenzací s bezvodým chloroformem a chloridem hlinitým → aromatické uhlovodíky poskytují barevné sloučeniny, alifatické uhlovodíky nereagují
- pro důkaz a identifikaci aromatických uhlovodíků se využívá elektronová a infračervená spektrofotometrie
- těkavé uhlovodíky se analyzují plynovou chromatografií
Halogensloučeniny
- přítomnost halogenu se projeví nižší rozpustností ve vodě a vyšší rozpustností v organických rozpouštědlech
- reaktivita halogenu závisí na typu vazby, druhu halogenu a organickém zbytku
- u halogenidů vázaných iontově (soli organických bazí) se halogenid dokazuje přímo ve vodném roztoku pomocí dusičnanu stříbrného → sraženina halogenidu stříbrného
- reaktivita halogenu klesá v pořadí: J - Br - Cl – F
Alkoholy
= alifatické hydroxysloučeniny, obsahují jednu nebo více hydroxylových skupin
- nízkomolekulární alkoholy jsou rozpustné ve vodě
- nižší alkoholy se identifikují pomocí plynové chromatografie
- xanthogenová reakce – jedná se o specifickou reakci alifatických hydroxysloučenin
Alkoholy: xanthogenová reakce
Princip reakce: Primární a sekundární alkoholy reagují se sirouhlíkem v alkalickém prostředí za vzniku ve vodě rozpustných žlutě zbarvených xanthogenanů, které lze dokázat přidáním kationtů různých kovů, např. mědnatých, vzniká hnědá sraženina xanthogenanu mědnatého
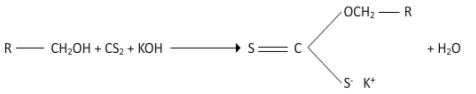
Provedení reakce: K malému množství vzorku ve zkumavce přidáme několik kapek sirouhlíku a asi 0,1g NaOH. Pozorujeme zežloutnutí a mírné zahřátí roztoku. Poté přidáme 5ml vody a po kapkách 5% roztok CuSO4. Pokud je ve zkoumaném vzorku přítomen příslušný alkohol, vytvoří se hnědá sraženina xanthogenanu měďnatého.
- reakce s acetylchloridem – používá se pro důkaz primárních a sekundárních alkoholů, vzniká chlorovodík a etylester kyseliny octové, který má charakteristický ovocný zápach ANL organických látek: alkoholy: reakce s acetylchloridem
- reakce s kyselinou chlorovodíkovou (Lucasova reakce) ANL organických látek: alkoholy: Lucasova reakce
Lucasovo činidlo = koncentrovaná HCl + bezvodý ZnCl2
- slouží k rozlišení primárních, sekundárních a terciárních alkoholů, vznikají ve vodě nerozpustné alkylchloridy; terciární alkoholy reagují okamžitě, reakce sekundárních alkoholů je pomalá a primární alkoholy s činidlem nereagují
- oxidační reakce s chromsírovou směsí – primární alkoholy reagují za vzniku aldehydů (důkaz Schiffovým činidlem), ze sekundárních vznikají ketony a terciární alkoholy nereagují ANL organických látek: alkoholy: oxidační reakce s chromsírovou směsí
- K důkazu terciárních alkoholů se používá reakce se síranem rtuťnatým (Denigesovo činidlo), terciární alkoholy reagují s Denigesovým činidlem za vzniku žluté až oranžové sraženiny.
Fenoly
= aromatické hydroxysloučeniny kyselého charakteru, většinou nerozpustné ve vodě; všechny fenoly mají redukční vlastnosti
- skupinové reakce
- reakce s hexakyanoželezitanem a železitými ionty (chlorid železitý) – vzniká berlínská modř (hexakyanoželeznatan)
- činidlo může být redukováno i jinými sloučeninami, tato reakce není pro fenoly selektivní
- reakce se stříbrnými ionty (Tollensova reakce) – tuto reakci poskytují vícemocné fenoly a aminofenoly, které mají silnější redukční vlastnosti a redukují stříbrné ionty na elementární stříbro
- selektivní reakce
- reakce s alkalickými hydroxidy – pro svůj kyselý charakter reagují jednofunkční fenoly s alkalickým hydroxidem za vzniku fenolátů
- reakce s diazinovou solí – při této reakci vznikají kopulační reakcí charakteristicky zbarvená azobarviva
- reakce se rtuťnatými ionty (Millonova reakce) – jednofunkční fenoly reagují s dusičnanem rtuťnatým (Millonovo činidlo) za vzniku červeného zbarvení
Karbonylové sloučeniny - aldehydy, ketony
Jedná se o látky s neutrálním charakterem. Aldehydy jsou pro své redukční schopnosti reaktivnější než ketony.
- skupinová reakce
- reakce s 2,4 – dinitrofenylhydrazinem – při této reakci vznikají žluté, oranžové nebo červené sraženiny hydrazinů
- selektivní reakce aldehydů
- reakce se stříbrnými ionty (Tollensova reakce) – aldehydy redukují Tollensovo činidlo (amoniakální roztok hydroxidu stříbrného) za vzniku elementárního stříbra, které se projeví vznikem černé sraženiny nebo lesklého zrcátka
pozn.: O selektivní zkoušku pro aldehyd jde pouze v případě vyloučení přítomnosti jiných redukujících sloučenin.
- reakce s Fehlingovým činidlem (roztok síranu mědnatého, vínanu draselnosodného a hydroxidu sodného) – dochází k redukci činidla za vzniku červené sraženiny oxidu měďnatého; aromatické aldehydy tuto reakci nedávají Selektivní reakce aldehydů s Fehlingovým činidlem
- reakce se Schiffovým činidlem (vodný roztok fuchsinu odbarvený hydrogensiřičitanem) – reakce probíhá při pH = 3, za vzniku modrofialového zbarvení
- selektivní reakce ketonů
- reakce s m-dinitrobenzenem – redukcí vzniká fialové zbarvení
Karbonylové sloučeniny lze identifikovat pomocí plynové chromatografie a kapalinové vysokoúčinné chromatografie.
Karboxylové kyseliny
- skupinové reakce
- hydroxamová reakce Karboxylové kyseliny: hydroxamová reakce
Karboxylová kyselina se převede na halogenid, který je reaktivnější a s hydroxylaminem reaguje za vzniku hydroxamové kyseliny, kterou dokážeme chloridem železitým → intenzivně červený chelát.
Provedení reakce: Na porcelánovou misku se dá asi 0,01g vzorku a přidají se tři kapky chloridu thionylu; na vodní lázni se odpaří do sucha (vzniká chlorid kyseliny). Nižší karboxylové kyseliny reagují za studena, odpadá odpařování.
Dále se přikápne roztok hydrochloridu hydroxylaminu a několik kapek alkoholického roztoku NaOH, roztok se zahřeje, přidá se několik kapek 2% HCl a nakonec několik kapek roztoku FeCl3.
Za přítomnosti karboxylové kyseliny vznikne červené zbarvení.
- převedení na nerozpustnou sůl
- přidáním dusičnanu stříbrného, olovnatého nebo barnatého vznikne nerozpustná sůl příslušné karboxylové kyseliny
- dikarboxylové kyseliny se dokáží jako nerozpustné vápenaté soli
Aminy
- skupinové reakce
- reakce s kyselinou dusitou ANL organických látek: aminy: skupinová reakce s kyselinou dusitou
reakcí aminů s HNO2 v prostředí minerálních kyselin, můžeme rozlišit typ aminu:
- - primární alifatické aminy uvolňují plynný dusík
- - primární aromatické aminy reagují za vzniku diazoniových solí, které v alkalickém prostředí dávají např. s 2-naftolem intenzivně zbarvené azobarvivo
- - sekundární alifatické aminy reagují za vzniku žlutých nitrosaminů
- - sekundární aromatické aminy reagují obdobně jako sekundární alifatické
- - terciární alifatické a aromatické aminy, stejně tak kvarterní amoniové soli s HNO2 nereagují
- isonitrilová reakce ANL organických látek: aminy: skupinová reakce izonitrilová
primární alifatické a aromatické aminy reagují s chloroformem v alkalickém prostředí za vzniku silně zapáchajícího isonitrilu; sekundární a terciární aminy tuto reakci nedávají
Provedení reakce: v 1ml etanolu se rozpustí asi 0,02 g vzorku, přidá se 0,1g KOH a několik kapek chloroformu a mírně se zahřeje. Nutno provádět v digestoři!
- reakce s ligninem
Kápnutím etanolového roztoku vzorku na novinový papír vznikají v přítomnosti primárních a sekundárních aromatických aminů oranžové nebo červené skvrny.
Jedná se o reakci cennou pro důkaz sekundárních aromatických aminů, jelikož primární aromatické aminy se dají poměrně jednoduše dokázat.
Amidy
- hydrolýza ANL organických látek: amidy: hydrolýza
amidy a imidy karboxylových a sulfonových kyselin dokážeme hydrolýzou na jejich původní složky → kyselina + amoniak (u substituovaných amidů vzniká amin)
- reakce s kyselinou dusitou
uvolňuje se příslušná kyselina a elementární dusík; reagují i poměrně rezistentní amidy
Nitro- a nitrososloučeniny
- redukce zinkem v prostředí HCl
vzniká příslušný amin, který se dokazuje (viz aminy)
- reakce s HNO2 (Nitrolová reakce)
primární a sekundární alifatické nitrosloučeniny reagují za vzniku barevných sloučenin; terciární a aromatické nereagují
(mechanizmus reakce není zcela objasněn)
- reakce s fenolem v silně kyselém prostředí
v silně kyselém prostředí (koncentrovaná H2SO4) se z nitrososloučenin uvolňuje HNO2, která reakcí s fenolem poskytuje barevný produkt
Na přítomnost terciárních alifatických a aromatických nitrosloučenin usuzujeme z pozitivní redukční reakce a negativního důkazu nitrososkupiny.
Organické soli
Častěji se používají soli organických zásad či organických kyselin, méně jsou zastoupeny soli s oběma složkami organickými.
Důkaz dvojné a trojné vazby ANL organických látek: důkaz dvojné a trojné vazby - rovnice
- Adiční reakce s bromem → odbarvení roztoku
- Oxidace manganistanem draselným → hnědá sraženina hydroxidu manganičitého + příslušný glykol