Komplexometrie je metoda založená na komplexotvorné reakci mezi stanovovanou látkou a odměrným činidlem. Při tomto typu reakcí se tvoří komplexní sloučeniny, které jsou sice rozpustné, ale málo disociované. Jejich složení je přesně definované a je vyjádřeno komplexními vzorci, ve kterých se vyskytují kromě kulatých závorek i závorky hranaté.
Vstupní předpoklady
- kationty, anionty, názvosloví iontů
- náboj iontů, oxidační číslo iontů, určení oxidačního čísla prvků ve sloučenině
- koordinačně-kovalentní vazba
- chemická rovnováha
- pH, úprava pH
- Základy teorie komplexů
Složení komplexních sloučenin
Komplexní látky mají molekuly tvořené buď elektricky neutrálním komplexem, nebo komplexní a nekomplexní částí s elektrickým nábojem (ionty). Sloučenina může mít komplexní kationt a nekomplexní aniont, nebo se může skládat z nekomplexního kationtu a komplexního aniontu.
| [Ni(CO)4] |
neutrální komplex |
| K4[Fe(CN)6] |
nekomplexní kationt a komplexní aniont |
| [Cu(H2O)4]SO4 |
komplexní kationt a nekomplexní aniont |
| [Pt(H2O)4] [PtCl6] |
komplexní kationt i komplexní aniont |
Komplexní část sloučeniny je uvedena v hranaté závorce a skládá se z centrálního atomu, který je následován ligandy, jejichž počet je vyjádřen koordinačním číslem. Víceprvkové ligandy se uvádějí v kulatých závorkách, jejich počet je vyjádřen dolním indexem za značkou (nebo vzorcem) ligandu. Koordinační číslo může převyšovat oxidační číslo centrálního atomu.
Centrální atom je spojen s ligandem koordinačně-kovalentní (donor akceptorovou) vazbou, to znamená, že musí obsahovat minimálně jeden prázdný elektronový orbital. Aby se mohla tato vazba vytvořit, je nezbytně nutná přítomnost alespoň jednoho volného elektronového páru v ligandu.
Náboj centrálního atomu nemusí nutně být nulový, ale může se jednat i o kationt kovu (pak se logicky zamění pojem centrální atom za centrální iont). Ligandy mohou být jedno i více atomové, s nábojem i bez něj. V další části textu jsou uvedeny příklady ligandů a jejich názvy:
Ligandy s nábojem
- F-, Cl-, Br-, I- fluoro-, chloro-, bromo-, iodo- (fluorido-, chlorido-, bromido-, iodido- )
- H- hydrido-
- OH- hydroxo- (hydroxido-)
- CN- kyano- (kyanido-)
- O2- oxo-
- S2- thio-
- NO2- nitro- (nitrito-)
Ligandy bez náboje
- H2O aqua-
- NO nitrosyl-
- NH3 ammin-
- CO karbonyl-
Názvosloví komplexních sloučenin
Při tvorbě vzorců a názvů je nutné, správně určit oxidační číslo centrálního atomu. Při tom se uplatňuje pravidlo, že celkový součet kladných a záporných oxidačních čísel v molekule je stejný.
K4I[Fex(CN)6-I]
Postup určení oxidačního čísla centrálního atomu:
- Oxidační číslo draslíku ve sloučenině je +I
- Celá komplexní část (v hranaté závorce) tedy musí mít ox. číslo –IV
- Protože CN je ligand s ox. číslem –I, a je jich celkem 6, musí Fe mít ox. číslo +II
(x = -1 x 6 + 2 = -4)
Název každé sloučeniny, která je tvořena kladnou a zápornou částí, je dvouslovný. Podstatné jméno je tvořeno od záporné části a přídavné jméno je odvozeno od kladné části atomu. Pořadí zápisu vzorce je však opačné, to znamená, že vzorec se převádí na název vlastně od konce.
Podstatné jméno je odvozeno od komplexní části a musí v něm být uveden
počet, druh ligandů a název centrálního atomu (iontu) s koncovkou, která odpovídá jeho oxidačnímu číslu (náboji). V případě K4[FeII(CN)6] se tedy podstatné jméno složí ze slov hexa kyanido želez natan. Přídavné jméno se utvoří od kladné části molekuly s koncovkou odpovídající jeho oxidačnímu číslu, v tomto případě draselný
Celý název sloučeniny K4[FeII(CN)6] je tedy hexakyanoželeznatan draselný.
Analogicky jsou utvořeny názvy sloučenin:
- Na[AuCl4] tetrachlorozlatitan sodný
- K[Co(CO)4] tetrakarbonylkobaltid draselný
- K3[Fe(CN)6] hexakyanoželezitan draselný
[Fe(CO)5]SO4
Název sloučeniny, kde je komplexní kationt a nekomplexní aniont, se tvoří takto:
- podstatné jméno je utvořeno od nekomplexní části = síran
- přídavné jméno je tvořeno od komplexní části, ve které má centrální atom oxidační číslo +II = penta karbonyl želez natý
Celý název sloučeniny [Fe(CO)5]SO4 je tedy síran pentakarbonylželeznatý
Analogicky se utvoří názvy sloučenin:
- [Ag(NH3)2]NO3 dusičnan diamminstříbrný
- [Cu(NH3)4](OH)2 hydroxid tetraamminměďnatý
- [AlH4]Cl3 chlorid tetrahydridohlinitý
Pokud je ve sloučenině více různých ligandů, musí se v názvu sloučenin objevit jejich název i počet v abecedním pořadí (předpony označující počet se do abecedního pořadí nezahrnují)
[Fe(CN)5(NO)] Cl2 chlorid pentakyano-nitrosylželezitý
Je-li oxidační číslo centrálního atomu i ligandů nulové, pak se název tvoří podstatným jménem v prvním nebo druhém pádu.
- [Co(CO)5] komplex pentakarbonyl kobaltu nebo pentakarbonylkobalt
- [Fe(NO)6] komplex hexanitrosyl železa nebo hexanitrosylželezo
Stálost komplexů
Reakce tvorby komplexů je vratná a rovnovážná konstanta této reakce se označuje jako konstanta stability komplexu:
M + nL ↔ [MLn]
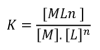
M … centrální atom kovu
L … ligandy
n … koordinační číslo
Komplexy silné se v roztocích rozkládají na své složky velmi málo a není je tedy možné běžnými chemickými reakcemi dokázat. Čím vyšší hodnotu konstanty stability má daný komplex, tím vhodnější je látka pro analytické účely.
Komplexy slabé jsou takové sloučeniny, které v roztoku uvolňují i menší množství svých složek, to znamená, že si uchovávají komplexní charakter pouze v krystalickém stavu. Příkladem slabých komplexů jsou např. podvojné soli (hlavně kamence).
Odměrné roztoky v komplexometrii
Existují látky, které jsou schopny obsadit více koordinačních míst centrálního atomu, to znamená, že jsou k centrálnímu atomu poutány více vazbami. Příkladem takového ligandu je např. ethylendiamin
H2N-CH2-CH2-NH2
Tato látka obsahuje po jednom volném elektronovém páru na každém dusíku. Znamená to, že dvě takovéto molekuly mohou vytvořit celkem 4 vazby s kovovým kationtem.
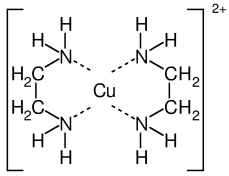
Uvedený kationt je uprostřed komplexu jakoby sevřený mezi dvěma klepety. Klepeto se řecky nazývá „chelé“ a odtud dostala metoda alternativní název chelatometrie.
Aminopolykarboxylové kyseliny jsou látky, které mají schopnost vytvářet s kovovými kationty mimořádně pevné komplexy (cheláty), takže tyto kovové kationty v bodě ekvivalence prakticky vymizí z roztoku. Reakce je rychlá a probíhá v přesných stechiometrických poměrech. Tyto látky Jsou proto velmi vhodnými činidly, která umožňují stanovení obsahu těchto kationtů.
Odměrnými roztoky v chelatometrii jsou tzv. chelatony (komplexony).
- Chelaton 1 je kyselina nitrilotrioctová, v chemických rovnicích uváděná symbolem H3X.
- Chelaton 2 je kyselina ethylendiaminotetraoctová, která se uvádí pomocí symbolu H4Y a nebo pomocí zkratky utvořené z jejího názvu EDTA (EthylenDiaminoTetra octová – kyselina octová = latinsky Acidum aceticum)
- Od této kyseliny je odvozena disodná sůl kyseliny EDTA (v ČL = edetan disodný), která se označuje jako chelaton 3 (komplexon III). Jedná se o nejčastěji používaný odměrný roztok a v chemických rovnicích je uváděn symbolem Na2H2Y . Protože látka se používá jako odměrný roztok, ve kterém je chelaton3 disociovaný účinkem vody, často je v iontových chemických rovnicích uváděn jen jeho účinný aniont H2Y2-.
Kromě výše uvedených chelatonů je známý též chelaton 4, což je kyselina 1,2-diaminocyklohexan N,N-tetraoctová.
Při zpětných a vytěsňovacích titracích (viz dále) se v chelatometrii často užívá také odměrný roztok MgSO4 nebo ZnSO4.
Reakce chelatonu 3 s kovovými kationty
Anion chelatonu 3 je schopen reagovat s kationty kovů, jejichž oxidační číslo je II, III, VI tak, že vždy reaguje jeden kationt s jedním aniontem podle chemických rovnic:
Z toho tedy plyne, že faktor titrace má v komplexometrii vždy hodnotu 1 a látková množství obou reagujících látek jsou tedy stejná.
Jako základní látky pro stanovení titru odměrných roztoků se v chelatometrii používají např. dusičnan olovnatý nebo uhličitan vápenatý.
Indikace bodu ekvivalence
Při určení bodu ekvivalence se používají tzv. metalochromní indikátory. Jedná se o látky, které vytvářejí se stanovovaným kovovým kationtem málo stálé, avšak intenzivně zabarvené komplexy, jejichž zabarvení je odlišné od barvy samotného indikátoru. Tyto látky pracují na principu, který je možné vyjádřit 3 fázemi:
- Do roztoku kovového kationtu (obecně Mn+) se přidá malé množství vhodného indikátoru (Ind-), který vytvoří s malou částí přítomných kovových kationtů intenzivně zabarvený komplex (MInd (n-1)+) podle rovnice:
- Při titraci chelatonem 3 vzniká pevný komplex kov-chelaton (MY (n-2)+) tak dlouho, dokud jsou v roztoku přítomny volné kovové kationty.
- Před bodem ekvivalence, kdy v roztoku už žádné volné kovové kationty nejsou, dojde k rozpadu málo pevných komplexů kov-indikátor ve prospěch vzniku pevnějších komplexů kov-chelaton. Tím se uvolní indikátor, který způsobí změnu zabarvení, protože jeho barva je odlišná od barvy nestabilního komplexu.
V komplexometrii se nepřipravují roztoky indikátorů jako v předchozích metodách, ale indikátor se aplikuje v pevném skupenství. Protože se ho přidává velmi malé množství, které by se obtížně dávkovalo, míchá se indikátor s indiferentní chemickou látkou (NaCl, KNO3) v poměru 1:100. Tato směs se pak většinou přidává do roztoku vzorku v množství „na špičku lžičky“.
Existuje celá řada metalochromních indikátorů, nejobvyklejšími jsou indikátory MUREXID, XYLENOLOVÁ ORANŽ, ERIOCHROMOVÁ ČERŇ T ( erio T), PYROKATECHINOVÁ VIOLEŤ a další.
Úprava pH
Při reakci kovového kationtu a chelatonu 3 dochází ve všech případech k uvolnění 2 vodíkových kationtů. Je známo, že pokud někde vznikají kationty H+, dochází k poklesu pH. Při klesajícím pH klesá také stabilita komplexů vznikajících při titraci. To by znamenalo, že při titraci vznikají komplexy, které se v zápětí rozpadají. Je zřejmé, že tato skutečnost by vedla k neúměrným spotřebám odměrného roztoku a výsledky by neodpovídaly obsahu stanovované látky. Proto je při titracích nutné upravovat pH.
Hodnotu pH je možné upravit použitím tlumivých roztoků nebo látek, které mají tlumivé účinky. Tlumivé roztoky se mohou též nazývat ústojné roztoky, pufry, popř. nárazníky.
Nejběžnější jsou dvousložkové tlumivé roztoky, složené buď ze slabé kyseliny a její soli (acetátový pufr), nebo ze slabé zásady a její soli (amoniakální pufr). Na stejném principu funguje též třeba fosfátový (nebo karbonátový) pufr, který obsahuje 2 soli kyseliny fosforečné (uhličité), z nichž každá má jiný počet vodíků. Takže jedna z těchto solí zastává funkci slabé kyseliny a druhá slabé zásady (soli).
Příklady pufrů:
- acetátový pufr: kyselina octová + octan sodný
- amoniakální pufr: hydroxid amonný + chlorid amonný
- fosfátový pufr: hydrogenfosforečnan sodný + dihydrogenfosforečnan sodný
- karbonátový pufr: uhličitan sodný + hydrogenuhličitan sodný
Funkce tlumívých roztoků
Chelatometrické titrace
V chelatometrii se používají 3 techniky titrací.
Nejčastěji se používá titrace přímá, při které se titruje analyzovaný vzorek, k němuž byl přidán tlumivý roztok a indikátor, přímo odměrným roztokem chelatonu3.
V některých případech je vhodnější provést titraci nepřímou (zpětnou). Je to v těch případech, kdy analyzovaný vzorek není dobře rozpustný ve vodě, ale rozpouští se v odměrném roztoku, nebo když tvorba komplexu je pomalá, popř. když se tvoří velmi pevná vazba mezi kovem a indikátorem. Pak se k analyzovanému vzorku, u kterého bylo upraveno pH, přidá nadbytek odměrného roztoku chelatonu 3. Přebytek tohoto odměrného roztoku se pak zjišťuje titrací odměrným roztokem síranu hořečnatého (popř. zinečnatého).
Zpětná titrace v chelatometrii
U vzorků, pro které nejsou vhodné indikátory, je možné provést též titraci vytěsňovací. Ta je založena na tom, že se k roztoku vzorku přidává nadbytek chelatonátu hořečnatého (MgY2-). Při reakci s analyzovaným kovovým kationtem dojde k vytěsnění určitého množství hořčíku, které odpovídá obsahu analyzovaného kovového kationtu ve vzorku. Jaké množství hořčíku bylo vytěsněno, se zjistí titrací odměrným roztokem chelatonu3. Protože při titraci reaguje s odměrným roztokem hořčík, použije se k indikaci bodu ekvivalence indikátor vhodný pro stanovení obsahu hořčíku (např. erioT).
Vytěsňovací titrace v chelatometrii
Využití komplexometrie ve zdravotnictví
Využití této metody je velmi rozsáhlé. Je možné ji využít např. ke stanovení tvrdosti vody nebo ke stanovení obsahu kovových kationtů ve farmaceutických přípravcích (kationty vápenaté, hořečnaté, hlinité, zinečnaté). Jako příklady je možné uvést oční kapky (Zn2+) – Zinci sulfatis oculoguttae, krémy (Al3+) - Aluminii acetotartratis cremor, masti (Zn2+) – Zinci oxidi unguentum.